Naam en adres van de houder van de vergunning voor het in de handel brengen
en de fabrikant verantwoordelijk voor vrijgifte, indien verschillend
Registratiehouder:Boehringer Ingelheim Vetmedica GmbH |
Fabrikant verantwoordelijk voor vrijgifte:Boehringer Ingelheim Vetmedica GmbH |
Aard van het middel
 Anti-hypertensivum.
Anti-hypertensivum.
Benaming van het diergeneesmiddel
Semintra 4 mg/ml orale oplossing voor katten
Telmisartan
Gehalte aan werkzame en overige bestanddelen
Eén ml bevat:
Telmisartan 4 mg
Benzalkoniumchloride 0,1 mg
Heldere, kleurloze tot geelachtige visceuze oplossing.
Indicaties
Vermindering van proteïnurie geassocieerd met chronische nierziekte bij katten.
Contra-indicaties
Niet gebruiken tijdens dracht of lactatie. Zie rubriek “Dracht en lactatie”.
Niet gebruiken bij overgevoeligheid voor het werkzame bestanddeel of één van de hulpstoffen.
Bijwerkingen
De volgende milde en voorbijgaande gastro-intestinale symptomen zijn zelden waargenomen in een klinische studie (in volgorde van afnemende frequentie): lichte en intermitterende oprispingen, braken, diarree of zachte feces.
Verhoogde leverenzymen zijn zeer zelden waargenomen. Indien deze wel aanwezig waren, normaliseerden deze binnen een paar dagen na stopzetting van de behandeling.
Daling van de bloeddruk en verlaging van de rodebloedceltelling zijn effecten die werden waargenomen bij de aanbevolen behandeldosis. Deze effecten zijn toe te schrijven aan de farmacologische activiteit van het product.
Alle bijwerkingen zijn gerangschikt op “frequentie” aan de hand van de volgende indeling:
- zeer vaak (meer dan 1 op de 10 dieren vertonen bijwerking(en) gedurende de duur van één behandeling)
- vaak (1 tot 10 van de 100 dieren)
- soms (1 tot 10 van de 1.000 dieren)
- zelden (1 tot 10 van de 10.000 dieren)
- zeer zelden (minder dan 1 van de 10.000 dieren, inclusief geïsoleerde rapporten).
Indien u ernstige bijwerkingen of andersoortige reacties vaststelt die niet in deze bijsluiter worden vermeld, wordt u verzocht uw dierenarts hiervan in kennis te stellen.
Diersoorten waarvoor het diergeneesmiddel bestemd is
Katten.
Dosering voor elke doeldiersoort, wijze van gebruik en toedieningsweg(en)
Voor oraal gebruik.
De aanbevolen dosering is 1 mg telmisartan/kg lichaamsgewicht (0,25 ml/kg lichaamsgewicht).
Het product dient eenmaal daags direct in de mond of met een kleine hoeveelheid voedsel te worden toegediend.
Semintra is een orale oplossing en wordt door de meeste katten goed geaccepteerd.
De oplossing dient te worden toegediend met behulp van de bijgesloten doseerspuit. De spuit past op de flacon en heeft een maatverdeling op basis van kg lichaamsgewicht.
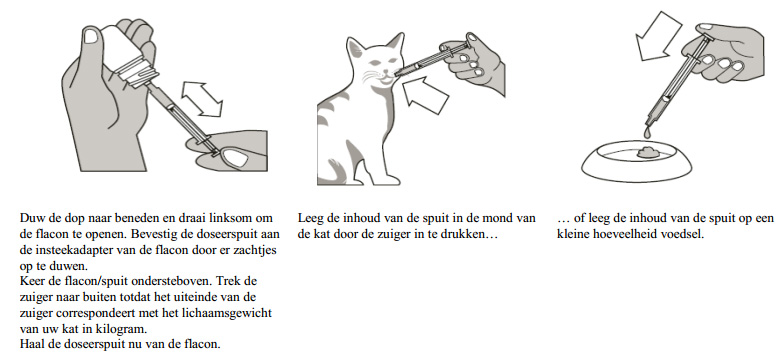
Aanwijzingen voor een juiste toediening
Sluit de flacon na toediening van het diergeneesmiddel stevig af met de dop, maak de maatspuit schoon met water en laat deze drogen.
Gebruik de meegeleverde spuit alleen om Semintra toe te dienen, om verontreiniging te voorkomen.
Wachttermijn
Niet van toepassing
Speciale voorzorgsmaatregelen bij bewaren
Buiten het bereik en zicht van kinderen bewaren.
Geen speciale voorzorgen voor de bewaring van dit diergeneesmiddel.
Houdbaarheid na eerste opening van de container: 6 maanden.
Niet te gebruiken na de vervaldatum vermeld op de doos en het etiket na “EXP”.
Speciale waarschuwingen
Voorzorgsmaatregelen voor gebruik bij dieren
De veiligheid en werkzaamheid van telmisartan is niet getest bij katten jonger dan 6 maanden.
Bij katten die behandeld worden met Semintra is het een goed klinisch gebruik om de bloeddruk te controleren wanneer de dieren onder anesthesie zijn.
Vanwege het werkingsmechanisme van het product kan tijdelijk hypotensie optreden. Bij verschijnselen van hypotensie dient symptomatische behandeling (bijv. vloeistoftherapie) te worden toegepast.
Zoals bekend is van stoffen die op het Renine Angiotensine Aldosteron Systeem (RAAS) inwerken, zou een lichte verlaging van de rodebloedceltelling voor kunnen komen. Tijdens de behandeling dient de rodebloedceltelling te worden gecontroleerd.
Voorzorgsmaatregelen, te nemen door degene die het diergeneesmiddel toedient
In geval van accidentele ingestie dient onmiddellijk een arts te worden geraadpleegd en hem de bijsluiter of het etiket te worden getoond.
Vermijd contact met de ogen. Bij accidenteel contact met de ogen dienen de ogen met water te worden uitgespoeld.
Was de handen na gebruik.
Zwangere vrouwen dienen extra voorzichtig te zijn en moeten contact met het product proberen te voorkomen. Dit omdat stoffen die werken op het RAAS, zoals Angiotensine Receptor Blokkers (ARBs) en ACE remmers, het ongeboren kind tijdens de zwangerschap bij mensen kunnen beïnvloeden.
Personen met een bekende overgevoeligheid voor telmisartan of andere sartans/ARBs moeten contact met het diergeneesmiddel vermijden.
Dracht en lactatie
De veiligheid van Semintra is niet bewezen bij drachtige en zogende katten, of katten die bestemd zijn voor de fokkerij.
Niet gebruiken tijdens dracht of lactatie (zie rubriek “Contra-indicaties”).
Interacties met andere geneesmiddelen en andere vormen van interactie
Bij gelijktijdige behandeling met amlodipine in de aanbevolen dosis werden geen klinische verschijnselen van hypotensie waargenomen.
Overdosering (symptomen, procedures in noodgevallen, antidota)
Na toediening van een dosis tot 5 keer de aanbevolen hoeveelheid gedurende een periode van 6 maanden werden geen bijwerkingen waargenomen anders dan die beschreven in rubriek"Bijwerkingen".
Toediening van het product in een overdosering (tot 5 keer de aanbevolen dosis gedurende 6 maanden), resulteerde in duidelijke daling van de bloeddruk, afname van de rodebloedceltelling (toe te schrijven aan de farmacologische activiteit van het product) en toename van het bloed ureum stikstof (BUN). Het is onwaarschijnlijk dat deze effecten onder klinische omstandigheden worden waargenomen.
Echter, in het geval dat zich tijdelijk hypotensie voordoet, dient symptomatische behandeling (bijv. vloeistoftherapie) te worden toegepast.
Onverenigbaarheid
Wegens het ontbreken van onderzoek naar onverenigbaarheden, mag dit diergeneesmiddel niet gemengd worden met andere diergeneesmiddelen.
Speciale voorzorgsmaatregelen voor het verwijderen van niet-gebruikte diergeneesmiddelen of eventuele restanten hiervan
Geneesmiddelen mogen niet worden verwijderd via afvalwater of huishoudelijk afval.
Vraag aan uw dierenarts hoe u overtollige geneesmiddelen verwijdert. Deze maatregelen dienen tevens ter bescherming van het milieu.
De datum waarop de bijsluiter voor het laatst is herzien**
19 november 2016
Overige informatie
Verpakking: Plastic 45 ml flacon gevuld met 30 ml of plastic 124 ml flacon gevuld met 100 ml.
1 doseerspuit.
Het kan voorkomen dat niet alle verpakkingsgrootten in de handel worden gebracht.
Gelieve voor alle informatie over dit diergeneesmiddel contact op te nemen met de lokale vertegenwoordiger van de houder van de vergunning voor het in de handel brengen.
Registratienummer: REG NL 111577
 **Datum laatste aanpassing bovenstaande bijsluitertekst op diergeneesmiddelen.info: 19 maart 2017 (NB het is mogelijk dat een eventuele nieuwere versie nog niet in de collectie van diergeneesmiddelen.info is verwerkt).
**Datum laatste aanpassing bovenstaande bijsluitertekst op diergeneesmiddelen.info: 19 maart 2017 (NB het is mogelijk dat een eventuele nieuwere versie nog niet in de collectie van diergeneesmiddelen.info is verwerkt).
Status voor gebruik bij dieren in Nederland
Uitsluitend verkrijgbaar bij een dierenarts of op recept van een dierenarts bij een apotheek.

 anti-diarree
anti-diarree